- 記事一覧
- ゲストライター記事一覧
- エイズの薬が認知症を治す?
エイズの薬が認知症を治す?

認知症患者は、世界的に急激な増加の一途をたどっている。日本の患者数は2012年の時点で約462万人、65歳以上の高齢者の約7人に1人が認知症と推計され、軽度認知症数の約400万人を合わせると、高齢者の約4人に1人が認知症あるいはその予備群という状況である。
そこで期待されているのが効果の高い認知症治療薬だ。現在まで承認されている認知症治療薬は、アルツハイマー病に対するアリセプト、ガランタミン,リバスチグミン,メマンチンである。メマンチン以外の3剤は、いずれもコリンエステラーゼ阻害作用により脳のアセチルコリンの減少を抑え,記憶や理解力と日常生活動作の改善に一定の効果があり、症状の進行を数ヵ月から1年ほど遅らせるといわれている。
ところが、フランス政府は2018年8月1日から、上記4剤の認知症治療薬を、公的医療保険の適用対象から外すことを決定した。これはフランスの医療技術評価機構が2007年から3回の評価を行い、次のように判断した結果である。すなわち、上記4剤について、病気の重症化を抑えられない、日々の生活の質をあげることもできない、施設への入居時期を遅らせることさえもできない、しかし、吐き気や食欲不振、下痢、めまいなどの副作用は無視できないとの理由であった。

こうした状況の中、人々の期待を集めているのが、認知症の症状をコントロールし、病気の進行を一時的に遅らせる薬剤ではなく、認知症の発病を根本から抑える治療薬の開発である。
これまでの根本治療薬の開発とは、アミロイド仮説に基づくものである。認知症の大多数を占めるアルツハイマー病では、脳内で異常に折り畳まれたアミロイドβ(Aβ)と呼ばれるタンパク質が蓄積することが分かっている。Aβは細胞膜を貫いて存在するアミロイド前駆体タンパク質(APP)の分解産物で、これが神経細胞外に蓄積し、凝集し、神経細胞を死に至らしめるというのである。アミロイドはいわばプラスチックごみのような物。対策はプラスチックごみを回収するか、プラスチックごみを作らないかの二つである。ごみを回収する方法としては、抗体を用いて神経細胞の外に堆積したアミロイドを除去する方法があり、ごみを作らない方法としては、アミロイドのもとになるAPPというタンパク質の Aβ部分を切り出す酵素(セレクターゼ)の働きを抑える阻害剤を用いる方法がある。この二つの治療法を巡って、世界中の大手製薬企業が次から次へと開発を続けてきたのである。
しかし、昨年8月、アリセプトを発売するエーザイとバイオジェンは、共同して開発してきたアデュカヌマブと呼ばれる抗体薬の臨床試験の中止を発表した。
抗体薬としては米ファイザー、イーライリリーに続く敗退。となると、アミロイドの増加を抑えるセレクターゼ阻害剤に期待したいところだが、これも患者の脳脊髄液中のアミロイドは減少したが、認知機能の改善にはつながらなかった。こうしてアミロイドを標的とする二方面からの作戦がことごとく失敗し、ついにアミロイド仮説を疑う声が上がってきた。神経細胞の外側の「ごみ」がADの主要な原因でないとすると、そのもとのアミロイドの前駆タンパク質(APP)に改めて注目が集まる。
話は1996年に遡る。その年、西本、山辻ら1)は、若年性認知症などを代表とする家族性アルツハイマー病に見られる変異APPが、細胞死(アポトーシス)を引き起こすことを発見した。その後、すべての家族性アルツハイマー病遺伝子の変異体が、神経細胞死を引き起こすことが確認された。家族性アルツハイマー病は遺伝性に発症するものなので、遺伝的な素因のない、高齢者に見られる一般的な認知症である孤発性アルツハイマー病の大多数には、この話は無関係と思われていたようである。
ところが、昨年11月、Ming-Hsiang Leeら2)は、画期的な研究成果を英国の科学雑誌Nature に発表した。それによると、孤発性アルツハイマー病の脳神経細胞のDNA含量は増加し、APP遺伝子のコピー数は2倍ないし3倍増加しているという先行論文を受けて、これは遺伝子の組み換えによるものではないかと考えて研究を進めた。その結果、APP遺伝子には、組み換えによって数千の変異が作られており、その一部に家族性アルツハイマー病と同じ変異を持ち、神経細胞毒性を示すものが認められた。これらの変異APP遺伝子はイントロンを欠くという構造的特徴から、遺伝子のDNA情報がメッセンジャーRNAに翻訳され、その後、逆転写酵素の働きでもう一度DNAに転換され、染色体上の別の場所に挿入された結果、生じたものと推定された。
これは音楽CDから音楽をスピーカに流すのではなく、パソコンへ取り込む操作に似ている。ただ問題は遺伝子の情報は生ものなので再挿入時にノイズ、いや、変異が入りやすいのである。挿入が起こりやすい条件としては、酸化ストレスによるDNA切断が実験的に示されている。
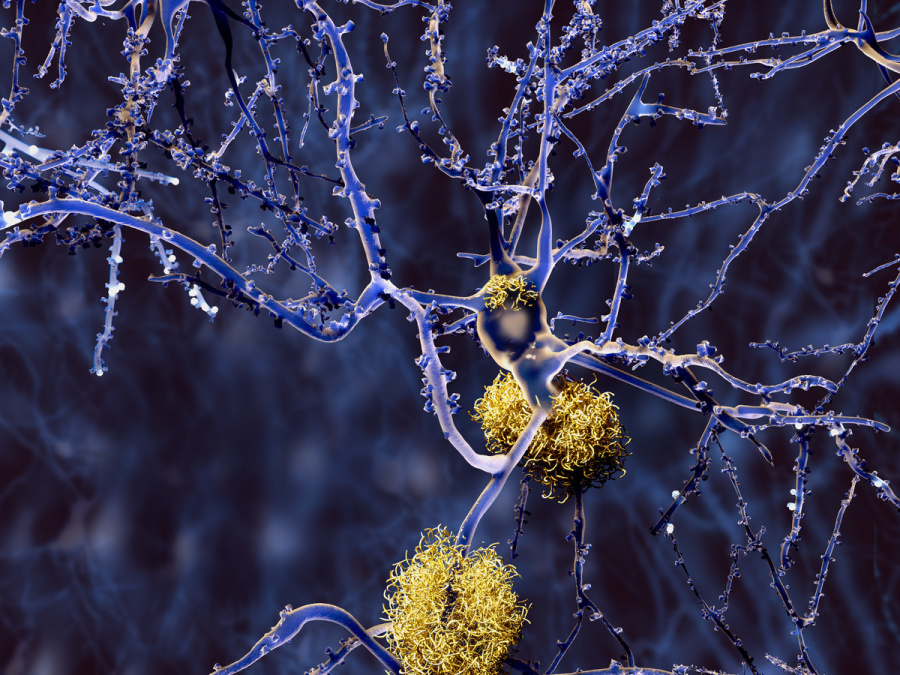
認知症の根本治療を考える際に大変興味深いことは、APP遺伝子が逆転写酵素の働きにより, 宿主細胞の染色体 DNAに組み込まれることで変異が生じる。さらに繰り返し組み込まれてその数を増やし、家族性アルツハイマー病と同じメカニズムで認知症を引き起こすという可能性が示されたのである。とすれば、逆転写酵素の働きを抑えれば、孤発性アルツハイマー病の発症を予防できるのではないかということが考えられる。しかし、APP遺伝子には逆転写酵素の働きはない。逆転写酵素活性を持っている他の遺伝子、老化と関連して活性化するLINE1(L1)、がんのマーカーとなるHERV(ヒト内在性レトロウイルス)などの遺伝子との協働が考えられるが、本研究ではこの点は検討されていない。
このような考えは今の段階では早計かもしれないが、論文の著者Leeが期待を込めて語っているように、APP遺伝子がレトロウイルスのように変異、増殖しているなら、RNAからDNAの転換を抑える逆転写酵素阻害剤を用いれば、アルツハイマー病(AD)の発病を抑制できる可能性がある。実は、その逆転写酵素阻害剤ならエイズ病治療の目的で既に多くの薬剤が開発されている。幸か不幸か、認知症では脳血液関門もその機能が障害されており、これらの薬も脳内に移行しやすいことであろう。
認知症に対する根本治療薬の新しい臨床試験が、開始されることを期待したい。
1) Yamatsuji T1, Okamoto T, Takeda S, Murayama Y, Tanaka N, Nishimoto I
.Expression of V642 APP mutant causes cellular apoptosis as Alzheimer trait-linked phenotype. EMBO J. 1996 Feb 1;15(3):498-509
2) Lee MH, Siddoway B, Kaeser GE, Segota I, Rivera R, Romanow WJ, Liu CS, Park C, Kennedy G, Long T, Chun J. Somatic APP gene recombination in Altzheimer’s disease and normal neurons. Nature 2018;563:639-645

Recently Popular最近よく読まれている記事
-

食べていても痩せる 高齢者終末期のカヘキシア(悪液質)
食べていても痩せる。活発に運動を続けている人なら不思議に思わないが、介護度の高い高齢者にそのようなことが果たして起こるのだろうか。起こるのであれば、それはカヘキシアという病態であれば説明できる。 カヘキシア(悪液質)カヘキシアとは、食欲不振・体重減少・全身衰弱・倦怠感などを呈し、生命予後やQOL(qualit… -

終末期の自然な経過を見極めるとは
長期に渡り胃ろうからの栄養を続けていると、注入した物が食道へ逆流したり、唾液や痰の貯留が増えたりして、吸引を繰り返すことになるが、結局のところ、頻回の吸引も間に合わず、心肺停止状態で発見されることが多い。これでは看取りとは言えない。ここに至るまでの言葉を語れない人の苦しみ。このような事態を避ける智慧… -

自閉症スペクトラムと呼ばれているような障害は、実は障害ではない。生物としての人類のバリエーション(変異)の一つである。
自閉症スペクトラムと呼ばれているような障害は、実は障害ではない。生物としての人類のバリエーション(変異)の一つである。本来は人類の、生息環境に対する適応の一つのあり方だというのが、ニューロダイバーシテイ(脳多様性)という考え方に他ならない(詳しくは正高信男著『ニューロダイバーシテイと発達障害』(北大… -

社会保障分野での普遍主義と選別主義について
介護保険や医療保険では、貧富にかかわらず保険によって9割が給付(自己負担は1割)あるいは、7割が給付(自己負担は3割)される。この様な社会保障の方式は、「普遍主義」といわれている。「普遍主義」は、義務教育や、最近では高等学校の授業料にも適応されている(この場合も裕福な人も貧しい人も同様に無償である)。反… -

飲まず食わず(自発的飲食中止)という選択、VSEDをご存知ですか?
前回(Opinionsで9月24日配信記事)は有馬斉氏による安楽死の分類と、我が国の現状についてお伝えしました。また我が国においては、医師の致死的薬剤の処方による積極的安楽死は、法的に支持されていないということもお話ししました。諸外国では医師による致死的薬剤処方による安楽死が認められている国もありますが、もち… -

医療崩壊
ある日の外来。朝の9時から診察室に座りっぱなしでそろそろ3時間が経過。既に再診患だけではなく、その日の新患も回ってきます。で、そうした中に問題のおじさんがいました。「今、○○クリニックで薬をもらっていまして・・・」「30日分貰っているのですが、お腹が痛くなったので、診てもらいに来ました」「○○先生の紹介…
Writer ライター
-
 受賞作品Opinionsエッセイ
受賞作品OpinionsエッセイOpinionsエッセイの記事を見る
-
 ペンネーム東沖 和季
ペンネーム東沖 和季東沖 和季の記事を見る
-
 ニセコ在住下田 伸一
ニセコ在住下田 伸一下田 伸一の記事を見る
-
 ペンネーム 看護師宇梶 正
ペンネーム 看護師宇梶 正宇梶 正の記事を見る
-
 武蔵野大学大学院大谷 航介
武蔵野大学大学院大谷 航介大谷 航介の記事を見る
-
 一般社団法人村楽東 大史
一般社団法人村楽東 大史東 大史の記事を見る
-
 会社員池松 俊哉
会社員池松 俊哉池松 俊哉の記事を見る
-
 (公財)橋本財団研究助成 成果報告
(公財)橋本財団研究助成 成果報告研究助成 成果報告の記事を見る
-
 横浜市立大学小林 天音
横浜市立大学小林 天音小林 天音の記事を見る
-
 東京西徳洲会病院小児医療センター 小児神経科医師秋谷 進
東京西徳洲会病院小児医療センター 小児神経科医師秋谷 進秋谷 進の記事を見る
-
 公益財団法人地方自治総合研究所 常任研究員坂本 誠
公益財団法人地方自治総合研究所 常任研究員坂本 誠坂本 誠の記事を見る
-
 ペンネームAurora
ペンネームAuroraAuroraの記事を見る
-
 つむぐ株式会社 代表取締役竹村 仁量
つむぐ株式会社 代表取締役竹村 仁量竹村 仁量の記事を見る
-
 岡山大学学術研究院医歯薬学域長谷井 嬢
岡山大学学術研究院医歯薬学域長谷井 嬢長谷井 嬢の記事を見る
-
 ソシエタス総合研究所 研究員Karki Shyam Kumar (カルキ シャム クマル)
ソシエタス総合研究所 研究員Karki Shyam Kumar (カルキ シャム クマル)Karki Shyam Kumar (カルキ シャム クマル)の記事を見る
-
 NPO法人妊娠しぇるとSOS 理事長小林 智子
NPO法人妊娠しぇるとSOS 理事長小林 智子小林 智子の記事を見る
-
 書きたい人のためのwebマガジンOpinions編集部
書きたい人のためのwebマガジンOpinions編集部Opinions編集部の記事を見る
-
 介護福祉士渡口 将生
介護福祉士渡口 将生渡口 将生の記事を見る
-
 相談支援専門員・福祉ネイリストゆき
相談支援専門員・福祉ネイリストゆきゆきの記事を見る
-
 株式会社ありがとうファーム取締役副社長馬場 拓郎
株式会社ありがとうファーム取締役副社長馬場 拓郎馬場 拓郎の記事を見る
-
 ジャーナリスト ペンネームジョワキン
ジャーナリスト ペンネームジョワキンジョワキンの記事を見る
-
 ソシエタス総合研究所 研究員Andi Holik Ramdani(アンディ ホリック ラムダニ)
ソシエタス総合研究所 研究員Andi Holik Ramdani(アンディ ホリック ラムダニ)Andi Holik Ramdani(アンディ ホリック ラムダニ)の記事を見る
-
 ソシエタス総合研究所 研究員Waode Hanifah Istiqomah(ワオデ ハニファー イスティコマー)
ソシエタス総合研究所 研究員Waode Hanifah Istiqomah(ワオデ ハニファー イスティコマー)Waode Hanifah Istiqomah(ワオデ ハニファー イスティコマー)の記事を見る
-
 元芝園団地自治会岡﨑 広樹
元芝園団地自治会岡﨑 広樹岡﨑 広樹の記事を見る
-
 岡山外語学院留学生カーン エムディ マムン
岡山外語学院留学生カーン エムディ マムンカーン エムディ マムンの記事を見る
-
 行政書士板垣 岳人
行政書士板垣 岳人板垣 岳人の記事を見る
-
 Crimson Education教育コンサルタント蘇 暁辰(Xiaochen Su)
Crimson Education教育コンサルタント蘇 暁辰(Xiaochen Su)蘇 暁辰(Xiaochen Su)の記事を見る
-
 神戸大学准教授斉藤 善久
神戸大学准教授斉藤 善久斉藤 善久の記事を見る
-
 ドイツ在住阿部プッシェル 薫
ドイツ在住阿部プッシェル 薫阿部プッシェル 薫の記事を見る
-
 ライター/編集者黒部 麻子
ライター/編集者黒部 麻子黒部 麻子の記事を見る
-
 翻訳家田尻 潤子
翻訳家田尻 潤子田尻 潤子の記事を見る
-
 アブダビ環境庁長官 Environment Agency – Abu Dhabi (ead.gov.ae)シャイカ・サレム・アル・ダヘリ
アブダビ環境庁長官 Environment Agency – Abu Dhabi (ead.gov.ae)シャイカ・サレム・アル・ダヘリシャイカ・サレム・アル・ダヘリの記事を見る
-
 元整形外科医/農園主散木洞人
元整形外科医/農園主散木洞人散木洞人の記事を見る
-
 豊橋技術科学大学パク ミンジョン
豊橋技術科学大学パク ミンジョンパク ミンジョンの記事を見る
-
 生理革命委員会澤田まりあ、山形萌花、山領珊南
生理革命委員会澤田まりあ、山形萌花、山領珊南澤田まりあ、山形萌花、山領珊南の記事を見る
-
 SOMPOケア株式会社藤田 定司
SOMPOケア株式会社藤田 定司藤田 定司の記事を見る
-
 おかやま山陽高等学校橘 里香サニヤ
おかやま山陽高等学校橘 里香サニヤ橘 里香サニヤの記事を見る
-
 ソシエタス総合研究所 研究員坂入 悦子
ソシエタス総合研究所 研究員坂入 悦子坂入 悦子の記事を見る
-
 Hiro山下行政書士国際法務事務所 代表山下裕司
Hiro山下行政書士国際法務事務所 代表山下裕司山下裕司の記事を見る
-
 ソシエタス総合研究所 研究員Niklas Holzapfel ホルツ アッペル ニクラス
ソシエタス総合研究所 研究員Niklas Holzapfel ホルツ アッペル ニクラスNiklas Holzapfel ホルツ アッペル ニクラスの記事を見る
-
 サウンドエンジニアEmre・Ekici エムレ・エキジ
サウンドエンジニアEmre・Ekici エムレ・エキジEmre・Ekici エムレ・エキジの記事を見る
-
 NPO法人岡山県国際団体協議会
NPO法人岡山県国際団体協議会岡山県国際団体協議会の記事を見る
-
 岡山大学 学術研究院 社会文化科学学域 教授東條 光彦
岡山大学 学術研究院 社会文化科学学域 教授東條 光彦東條 光彦の記事を見る
-
 福岡大学 名誉教授田村 和夫
福岡大学 名誉教授田村 和夫田村 和夫の記事を見る
-
 ソシエタス総合研究所 研究員相川 真穂
ソシエタス総合研究所 研究員相川 真穂相川 真穂の記事を見る
-
 一般社団法人京都総合科学研究所 アドバイザー松村 道郎
一般社団法人京都総合科学研究所 アドバイザー松村 道郎松村 道郎の記事を見る
-
 ワラム株式会社 代表取締役加藤 侑子
ワラム株式会社 代表取締役加藤 侑子加藤 侑子の記事を見る
-
 岡山市立操南中学校 教諭/NPO法人国際協力研究所・岡山代表理事竹島 潤
岡山市立操南中学校 教諭/NPO法人国際協力研究所・岡山代表理事竹島 潤竹島 潤の記事を見る
-
 新西横浜街の予防医療ケア研究室 保健師・看護師・元先端バイオ創薬ベンチャー取締役五十嵐 直敬
新西横浜街の予防医療ケア研究室 保健師・看護師・元先端バイオ創薬ベンチャー取締役五十嵐 直敬五十嵐 直敬の記事を見る
-
 共著橋本俊明・秋吉湖音
共著橋本俊明・秋吉湖音橋本俊明・秋吉湖音の記事を見る
-
 ライター菊池 洋勝
ライター菊池 洋勝菊池 洋勝の記事を見る
-
 大東文化大学国際関係学部・特任教授 高崎経済大学経済学部・非常勤講師 目白大学経営学部経営学科&目白大学大学院経営学研究科 非常勤講師 長崎県佐世保市役所 経済活性化~産業振興に関するアドバイザー、博士(経済学)江崎 康弘
大東文化大学国際関係学部・特任教授 高崎経済大学経済学部・非常勤講師 目白大学経営学部経営学科&目白大学大学院経営学研究科 非常勤講師 長崎県佐世保市役所 経済活性化~産業振興に関するアドバイザー、博士(経済学)江崎 康弘江崎 康弘の記事を見る
-
 ソシエタス総合研究所 研究員秋吉 湖音
ソシエタス総合研究所 研究員秋吉 湖音秋吉 湖音の記事を見る
-
 JICA専門家足立 伸也
JICA専門家足立 伸也足立 伸也の記事を見る
-
 富士通株式会社 第三ファイナンス事業本部 シニアマネージャー安留 義孝
富士通株式会社 第三ファイナンス事業本部 シニアマネージャー安留 義孝安留 義孝の記事を見る
-
 EDAS(イーダス)理事長田村 拓
EDAS(イーダス)理事長田村 拓田村 拓の記事を見る
-
 監督・プロデューサー湯浅 典子
監督・プロデューサー湯浅 典子湯浅 典子の記事を見る
-
 日本経済大学 准教授山下 誠矢
日本経済大学 准教授山下 誠矢山下 誠矢の記事を見る
-
 人と医療の研究室 代表池尻 達紀
人と医療の研究室 代表池尻 達紀池尻 達紀の記事を見る
-
 一般社団法人飛島学園 代表理事堂野 博之
一般社団法人飛島学園 代表理事堂野 博之堂野 博之の記事を見る
-
 ニッセイ基礎研究所 生活研究部 主任研究員、ヘルスケアリサーチセンター・ジェロントロジー推進室兼任金 明中
ニッセイ基礎研究所 生活研究部 主任研究員、ヘルスケアリサーチセンター・ジェロントロジー推進室兼任金 明中金 明中の記事を見る
-
 医療法人財団足立病院 理事長、社会福祉法人あだち福祉会 理事長畑山 博
医療法人財団足立病院 理事長、社会福祉法人あだち福祉会 理事長畑山 博畑山 博の記事を見る
-
 教育研究家、合同会社ライフ&ワーク代表妹尾 昌俊
教育研究家、合同会社ライフ&ワーク代表妹尾 昌俊妹尾 昌俊の記事を見る
-
 ハーバード大学ベス・イスラエル・ディーコネス・メディカルセンター、高度消化管/最小侵襲外科フェロー中元 啓太郎
ハーバード大学ベス・イスラエル・ディーコネス・メディカルセンター、高度消化管/最小侵襲外科フェロー中元 啓太郎中元 啓太郎の記事を見る
-
 ソシエタス総合研究所 主任研究員井上 登紀子
ソシエタス総合研究所 主任研究員井上 登紀子井上 登紀子の記事を見る
-
 ソシエタス総合研究所 研究員松田 郁乃
ソシエタス総合研究所 研究員松田 郁乃松田 郁乃の記事を見る
-
 ソシエタス総合研究所 研究員アイシェ・ウルグン・ソゼン Ayse Ilgin Sozen
ソシエタス総合研究所 研究員アイシェ・ウルグン・ソゼン Ayse Ilgin Sozenアイシェ・ウルグン・ソゼン Ayse Ilgin Sozenの記事を見る
-
 NPO法人岡山市子どもセンター 事務局久川 春菜
NPO法人岡山市子どもセンター 事務局久川 春菜久川 春菜の記事を見る
-
 ユースワーカー(Youth Woker)森分 志学
ユースワーカー(Youth Woker)森分 志学森分 志学の記事を見る
-
 ペンネーム三村 喜久雄
ペンネーム三村 喜久雄三村 喜久雄の記事を見る
-
 ペンネーム黒木 洋一郎
ペンネーム黒木 洋一郎黒木 洋一郎の記事を見る
-
 NPO法人チャリティーサンタ 理事河津 泉
NPO法人チャリティーサンタ 理事河津 泉河津 泉の記事を見る
-
 金沢大学人間社会学域地域創造学類・准教授 、特定非営利活動法人国土利用再編研究所・理事長林 直樹
金沢大学人間社会学域地域創造学類・准教授 、特定非営利活動法人国土利用再編研究所・理事長林 直樹林 直樹の記事を見る
-
 認定NPO法人ペアレント・サポートすてっぷ理事長安藤希代子
認定NPO法人ペアレント・サポートすてっぷ理事長安藤希代子安藤希代子の記事を見る
-
 カリフォルニア大学サンフランシスコ校小児胸部心臓外科教授佐野俊二
カリフォルニア大学サンフランシスコ校小児胸部心臓外科教授佐野俊二佐野俊二の記事を見る
-
 社会福祉法人 旭川荘 ひらたえがお保育園 園長江田 加代子
社会福祉法人 旭川荘 ひらたえがお保育園 園長江田 加代子江田 加代子の記事を見る
-
 NPO法人 おかやまUFE 副理事長 ・NPO法人 おかやまUFE 事務局阪井 ひとみ・永松千恵
NPO法人 おかやまUFE 副理事長 ・NPO法人 おかやまUFE 事務局阪井 ひとみ・永松千恵阪井 ひとみ・永松千恵 の記事を見る
-
 社会学者 東京大学名誉教授 認定NPO法人ウィメンズアクションネットワーク(WAN)理事長 上野 千鶴子
社会学者 東京大学名誉教授 認定NPO法人ウィメンズアクションネットワーク(WAN)理事長 上野 千鶴子上野 千鶴子 の記事を見る
-
 外務省 国際保健政策室長 鷲見 学
外務省 国際保健政策室長 鷲見 学鷲見 学の記事を見る
-
 プロ・アダプティブ・サーファー藤原(旧姓:川上)智貴
プロ・アダプティブ・サーファー藤原(旧姓:川上)智貴藤原(旧姓:川上)智貴の記事を見る
-
 京都大学霊長類研究所 教授正高信男
京都大学霊長類研究所 教授正高信男正高信男の記事を見る
-
 社会医療法人石川記念会HITO病院緩和ケア内科統括部長大坂巌
社会医療法人石川記念会HITO病院緩和ケア内科統括部長大坂巌大坂巌の記事を見る
-
 東京医療学院大学保健医療学部教授上田 諭
東京医療学院大学保健医療学部教授上田 諭上田 諭の記事を見る
-
 「夢を叶える145」ライター宮村孝博
「夢を叶える145」ライター宮村孝博宮村孝博の記事を見る
-
 NPO法人 Anneの家 代表 美作地区里親会会員松本芳也・淳子夫妻
NPO法人 Anneの家 代表 美作地区里親会会員松本芳也・淳子夫妻松本芳也・淳子夫妻の記事を見る
-
 特定非営利活動法人あかね 代表理事中山 遼
特定非営利活動法人あかね 代表理事中山 遼中山 遼の記事を見る
-
 大阪市立総合医療センター 緩和医療科部長 兼 緩和ケアセンター長 大阪市立大学医学部臨床准教授 一般社団法人「こどものホスピスプロジェクト」常務理事 日本小児科学会専門医 英国カーディフ大学緩和ケア認定医(Certificate in Palliative Care) 日本緩和医療学会暫定多田羅竜平
大阪市立総合医療センター 緩和医療科部長 兼 緩和ケアセンター長 大阪市立大学医学部臨床准教授 一般社団法人「こどものホスピスプロジェクト」常務理事 日本小児科学会専門医 英国カーディフ大学緩和ケア認定医(Certificate in Palliative Care) 日本緩和医療学会暫定多田羅竜平多田羅竜平の記事を見る
-
 NPO法人 岡山マインド「こころ」/代表理事 一般社団法人お互いさま・まびラボ/副代表理事多田伸志
NPO法人 岡山マインド「こころ」/代表理事 一般社団法人お互いさま・まびラボ/副代表理事多田伸志多田伸志の記事を見る
-
 一般社団法人MY TREE代表理事 MY TREEペアレンツ・プログラムスーパーバイザー 認定フェミニストカウンセラー (公認心理師)中川和子
一般社団法人MY TREE代表理事 MY TREEペアレンツ・プログラムスーパーバイザー 認定フェミニストカウンセラー (公認心理師)中川和子中川和子の記事を見る
-
 兵庫県立ひょうごこころの医療センター精神科医師小田 陽彦
兵庫県立ひょうごこころの医療センター精神科医師小田 陽彦小田 陽彦の記事を見る
-
 独立行政法人国立病院機構福山医療センター院長岩垣博己・堀井城一朗・矢野 平
独立行政法人国立病院機構福山医療センター院長岩垣博己・堀井城一朗・矢野 平岩垣博己・堀井城一朗・矢野 平の記事を見る
-
 岡山大学 教授 文学部長田中 共子
岡山大学 教授 文学部長田中 共子田中 共子の記事を見る
-
 Civil Engineer (仕組みつくりの技術者)石田篤史
Civil Engineer (仕組みつくりの技術者)石田篤史石田篤史の記事を見る
-
 一般財団法人キヤノングローバル戦略研究所 研究主幹・経済学博士松山幸弘
一般財団法人キヤノングローバル戦略研究所 研究主幹・経済学博士松山幸弘松山幸弘の記事を見る
-
 岡山大学生殖補助医療技術教育研究センター ART教育研究部門長・教授舟橋 弘晃
岡山大学生殖補助医療技術教育研究センター ART教育研究部門長・教授舟橋 弘晃舟橋 弘晃の記事を見る
-
 医療法人サンズ理事長浅野 直
医療法人サンズ理事長浅野 直浅野 直の記事を見る
-
 株式会社ヘリオス 代表執行役社長CEO鍵本忠尚
株式会社ヘリオス 代表執行役社長CEO鍵本忠尚鍵本忠尚の記事を見る
-
 慶應義塾大学文学部人間科学専攻教授(医療人類学) McGill大学人類学部・医療社会研究学部Ph.D.北中淳子
慶應義塾大学文学部人間科学専攻教授(医療人類学) McGill大学人類学部・医療社会研究学部Ph.D.北中淳子北中淳子の記事を見る
-
 岡山大学病院 緩和支持医療科片山英樹
岡山大学病院 緩和支持医療科片山英樹片山英樹の記事を見る
-
 岡山市役所 保健福祉企画総務課松岡克朗
岡山市役所 保健福祉企画総務課松岡克朗松岡克朗の記事を見る
-
 近現代史研究家青木康嘉
近現代史研究家青木康嘉青木康嘉の記事を見る
-
 独立行政法人国立病院機構福山医療センター院長岩垣博己・長谷川利路・中島正勝
独立行政法人国立病院機構福山医療センター院長岩垣博己・長谷川利路・中島正勝岩垣博己・長谷川利路・中島正勝の記事を見る
-
 岡山高等学院 副校長 水野文一郎
岡山高等学院 副校長 水野文一郎水野文一郎の記事を見る
-
 社会の仕組み屋、社会の編集者石原 達也
社会の仕組み屋、社会の編集者石原 達也石原 達也の記事を見る
-
 一般社団法人SGSG理事長/中国学園大学子ども学部講師野村泰介
一般社団法人SGSG理事長/中国学園大学子ども学部講師野村泰介野村泰介の記事を見る
-
 一橋大学経済研究所 教授神林 龍
一橋大学経済研究所 教授神林 龍神林 龍の記事を見る
-
 特定医療法人自由会 理事 (社会福祉法人敬友会 理事、公益財団法人橋本財団 理事)橋本 健二
特定医療法人自由会 理事 (社会福祉法人敬友会 理事、公益財団法人橋本財団 理事)橋本 健二橋本 健二の記事を見る
-
 医療法人社団 岡山二人クリニック 理事長、医学博士林 伸旨
医療法人社団 岡山二人クリニック 理事長、医学博士林 伸旨林 伸旨の記事を見る
-
 フリーライター渡辺嗣郎(わたなべ しろう)
フリーライター渡辺嗣郎(わたなべ しろう)渡辺嗣郎(わたなべ しろう)の記事を見る
-
 国立大学法人岡山大学 副理事(国際担当)横井 篤文
国立大学法人岡山大学 副理事(国際担当)横井 篤文横井 篤文の記事を見る
-
 ペンネームドクターX
ペンネームドクターXドクターXの記事を見る
-
 NPO法人 山村エンタープライズ 代表理事藤井裕也
NPO法人 山村エンタープライズ 代表理事藤井裕也藤井裕也の記事を見る
-
 キャンサー・ソリューションズ株式会社 代表取締役社長桜井 なおみ
キャンサー・ソリューションズ株式会社 代表取締役社長桜井 なおみ桜井 なおみの記事を見る
-
 AMDA(アムダ) グループ代表・認定非営利活動法人AMDA 理事長菅波 茂
AMDA(アムダ) グループ代表・認定非営利活動法人AMDA 理事長菅波 茂菅波 茂の記事を見る
-
 ふれあい歯科ごとう代表五島 朋幸
ふれあい歯科ごとう代表五島 朋幸五島 朋幸の記事を見る
-
 介護従事者髙田 浩一
介護従事者髙田 浩一髙田 浩一の記事を見る
-
 ケアマネ-ジャー・社会福祉士かえる ちから
ケアマネ-ジャー・社会福祉士かえる ちからかえる ちからの記事を見る
-
 五常・アンド・カンパニー株式会社 代表取締役社長慎 泰俊
五常・アンド・カンパニー株式会社 代表取締役社長慎 泰俊慎 泰俊の記事を見る
-
 NPO法人 ポケットサポート代表理事三好 祐也
NPO法人 ポケットサポート代表理事三好 祐也三好 祐也の記事を見る
-
 医療法人 寺田病院 院長板野 聡
医療法人 寺田病院 院長板野 聡板野 聡の記事を見る
-
 鳥取市立病院 地域医療総合支援センター 生活支援室 副室長、リハビリテーション部 副部長、歯科 医長目黒 道生
鳥取市立病院 地域医療総合支援センター 生活支援室 副室長、リハビリテーション部 副部長、歯科 医長目黒 道生目黒 道生の記事を見る
-
 鳥取市立病院地域医療総合支援センター長 鳥取市福祉部参与足立 誠司
鳥取市立病院地域医療総合支援センター長 鳥取市福祉部参与足立 誠司足立 誠司の記事を見る
-
 ペンネーム池井戸 高志
ペンネーム池井戸 高志池井戸 高志の記事を見る
-
 ペンネーム池田 出水
ペンネーム池田 出水池田 出水の記事を見る
-
 岡山大学大学院ヘルスシステム統合科学研究科教授松岡 順治
岡山大学大学院ヘルスシステム統合科学研究科教授松岡 順治松岡 順治の記事を見る
-
 鳥取市立病院 名誉院長田中 紀章
鳥取市立病院 名誉院長田中 紀章田中 紀章の記事を見る
-
 岡山大学大学院保健学研究科 副研究科長 教授齋藤 信也
岡山大学大学院保健学研究科 副研究科長 教授齋藤 信也齋藤 信也の記事を見る
-
 公益財団法人橋本財団 理事長、医学博士橋本 俊明
公益財団法人橋本財団 理事長、医学博士橋本 俊明橋本 俊明の記事を見る